華為云發布盤古藥物分子大模型,開啟AI藥物研發新模式
【中國,深圳,2021年9月23日】今日,主題為“深耕數字化”的華為全聯接2021隆重開幕,華為高級副總裁、華為云CEO、消費者云服務總裁張平安發表“深耕數字化,一切皆服務”主題演講,并重磅發布了華為云盤古藥物分子大模型。
華為高級副總裁、華為云CEO、消費者云服務總裁張平安發布華為云盤古藥物分子大模型
今年4月,華為云發布了盤古系列預訓練大模型,包括自然語言處理(NLP)大模型、計算機視覺(CV)大模型、多模態大模型和科學計算大模型。華為云盤古藥物分子大模型是“盤古家族”的新成員,是專門面向藥物研發領域推出的預訓練大模型,旨在幫助醫藥公司開啟AI輔助藥物研發的新模式。
一款創新藥從研發到上市,平均成本超過10億美元、研發周期大于10年——這是醫藥界公認的“雙10定律”。同時,藥物結構設計強烈依賴專家經驗、新藥篩選失敗率高,如何通過大數據、人工智能等科學技術加速新藥研發進程、平衡研發投入與成果產出之間的關系,成為了醫藥公司在數字化改革道路上的重點之一。
針對上述難題,華為云深度聯合中國科學院上海藥物研究所,共同訓練了華為云盤古藥物分子大模型,賦能全流程的AI藥物設計。依托華為云一站式醫療研發平臺EIHealth,盤古藥物分子大模型學習了17億個藥物分子的化學結構。在藥物生成方面,實現了對小分子化合物的獨特信息的深度表征、對靶點蛋白質的計算與匹配,以及對新分子生化屬性的預測,從而高效生成藥物新分子;在藥物優化方面,實現了對篩選后的先導藥進行定向優化。
華為云盤古藥物分子大模型具備以下四大技術和創新能力:
l 提出了針對化合物表征學習的全新深度學習網絡架構
參考化學領域的化合物分子表達形式及轉換方式,華為云盤古藥物分子大模型首次采用“圖-序列不對稱條件變分自編碼器”架構,可以自動找出化合物關鍵的分子特征指紋,極大地提升了下游任務的準確性。
l 進行了超大規模化合物表征模型的訓練
華為云盤古藥物分子大模型對市面上真實存在的17億個藥物分子的化學結構進行預訓練,在化學無監督學習模式下,實現結構重構率、合法性、唯一性等指標全面優于現有方法。
l 生成了擁有1億個新化合物的數據庫
華為云盤古藥物分子大模型的分子生成器生成了1億個創新的類藥物小分子篩選庫,其結構新穎性為99.68%,并且可以有效地生成理化性質相似的新化合物,為發現新藥創造可能性。此外,基于盤古分子優化器,科研人員實現了對起始分子化學結構的優化,并且能夠改善藥物分子的特性。
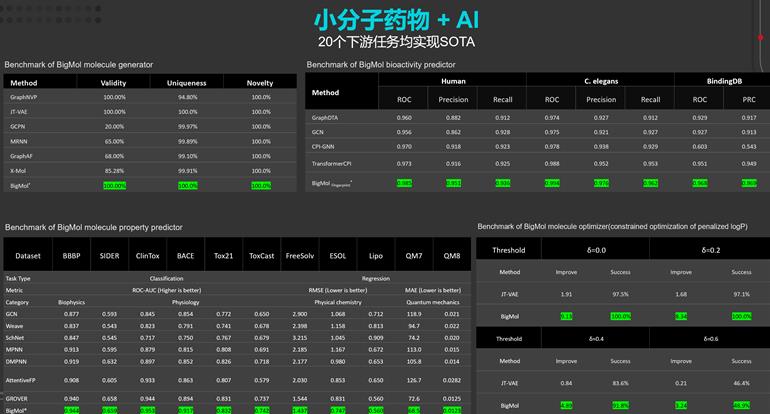
l 在20余項藥物發現任務上實現性能最優(SOTA)
華為云盤古藥物分子大模型在多項任務中取得了領先的預測準確度,包括化合物-靶標相互作用預測、化合物ADME/T屬性評分、化合物分子生成與優化等,實現了一個大模型賦能藥物發現全鏈條任務。
華為云盤古藥物分子大模型在20余項藥物發現任務上實現性能最優
華為云盤古藥物分子大模型依托華為云醫療智能體EIHealth平臺,其設計在2020年和2021年連獲兩屆德國RedDot紅點設計大獎,提供了更加友好的用戶體驗和易用性,能夠更高效地輔助科研人員完成智能藥物篩查和藥物優化生成,讓每一個醫療行業工作者都可以方便地利用AI解決工作中遇到的問題。
在實際應用中,華為云聯合西安交通大學第一附屬醫院,基于華為云盤古藥物分子大模型研發出全新的廣譜抗菌藥物,將先導藥的研發周期從數年縮短至一個月,大幅提升新藥研發效率。其中,通過華為云盤古藥物分子大模型的結構優化器,有效地提升了小分子化合物與目標抗菌靶點蛋白的結合,同時降低其與人體蛋白的結合,從而減弱了廣譜抗菌藥對人體正常細胞可能產生的毒副作用。
如今,AI在藥物研發的應用已經進入指數增長區。全球44家頂尖藥企中,已有41家藥企與AI公司建立合作關系。華為云將在盤古藥物分子大模型與醫療智能體EIHealth等服務上持續創新,繼續攜手生態伙伴,聚焦AI藥物研發領域的前沿技術,助力提升新藥研發的效率、成功率和創新能力,為守護人類生命健康貢獻更多力量。