機器魚游得比真魚還快!人體心肌細胞捏的紙片魚能自主游動108天
美國哈佛大學與埃默里大學研究人員合作,利用人類干細胞來源的心肌細胞制造出一種「人造魚」。 這種生物混合裝置同時包含生物和人工部分,能通過與心臟搏動機理相同的心肌細胞縮張律動,在水中自主游動超過100天。這一成果有助于開發由活性肌肉細胞制成的人造心臟,并為研究心律失常等心臟病提供平臺。 相關論文2022年2月10日發表在《科學》雜志上。

人造心肌細胞如何讓紙魚游動
人類心臟在不需大腦信號指令時就能自動泵血,這是靠心肌細胞內的電信號與機能結構性反饋完成的。不過此過程并非完全被研究者掌握 哈佛大學的研究者Kit Parker與他的同事們,用塑料紙、生物凝膠、和兩面由人類心肌細胞構成的「鰭」做出了生物性合成魚,藉此來更好理解心肌律動的物理過程。 2012年,該研究團隊曾用大鼠心肌細胞制造了水母形狀的生物復合泵。2016年,該研究團隊又用大鼠心肌細胞制造了能游動的人造魟魚。 這種生物性合成魚具有拮抗的肌肉雙層和幾何絕緣的心臟組織,節點包含人類干細胞來源的心肌細胞。
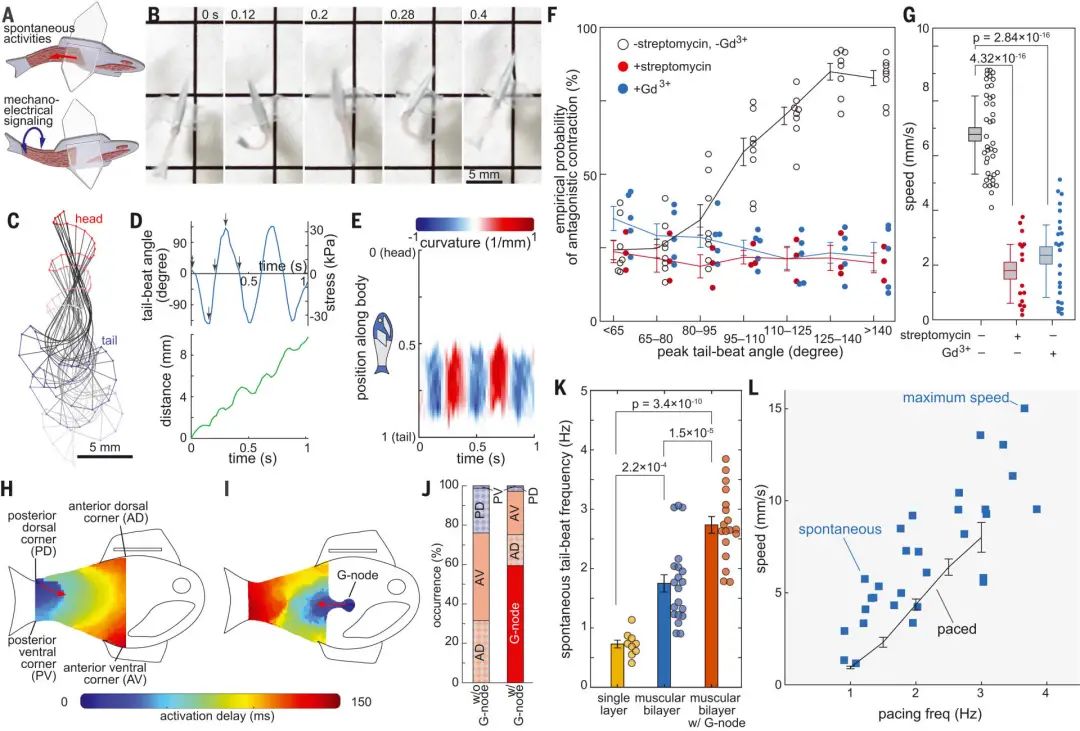
人造魚的結構示意、與真魚的游速比較 在生物性合成魚的肌肉雙層結構中,心肌細胞層的兩側機械被耦合在一起,使一側肌肉的收縮可以直接轉化為對側肌肉的軸向拉伸,導致拮抗肌肉的興奮和收縮。 魚的軀體由五個不同的部分組成。一層是從人類干細胞中提取的心肌組織,一層是用激光做的硬紙層,接下來是一層動物膠,然后又是一層紙,最后是一層肌肉組織。 魚尾鰭的部分是兩層心肌細胞耦合處。鰭一側的細胞收縮,那么另一側的細胞就會擴張,循環往復。這個循環使得尾鰭可以前后擺動,以此推動人造魚。 生物性合成魚一側的自發激活和收縮,可以通過肌肉組織之間的機械耦合,導致另一側隨后的拮抗收縮。 這些自發的對抗收縮導致魚有節奏地進行交替彎曲運動,產生向前的游動。

為了系統地呈現肌肉雙分子層的運動學特征,研究團隊通過外部光刺激控制生物性合成魚的拮抗肌肉收縮。 人造魚的肌肉雙分子層被藍色和紅色發光二極管光脈沖交替刺激。在紅光刺激下,左側肌肉組織開始收縮;在藍光的刺激下,右肌肉組織被誘導收縮,尾巴以近乎筆直的姿勢縮回。產生有節奏地向前連續推力來實現前進。
光刺激驅動實驗記錄
在人造魚上復現心律
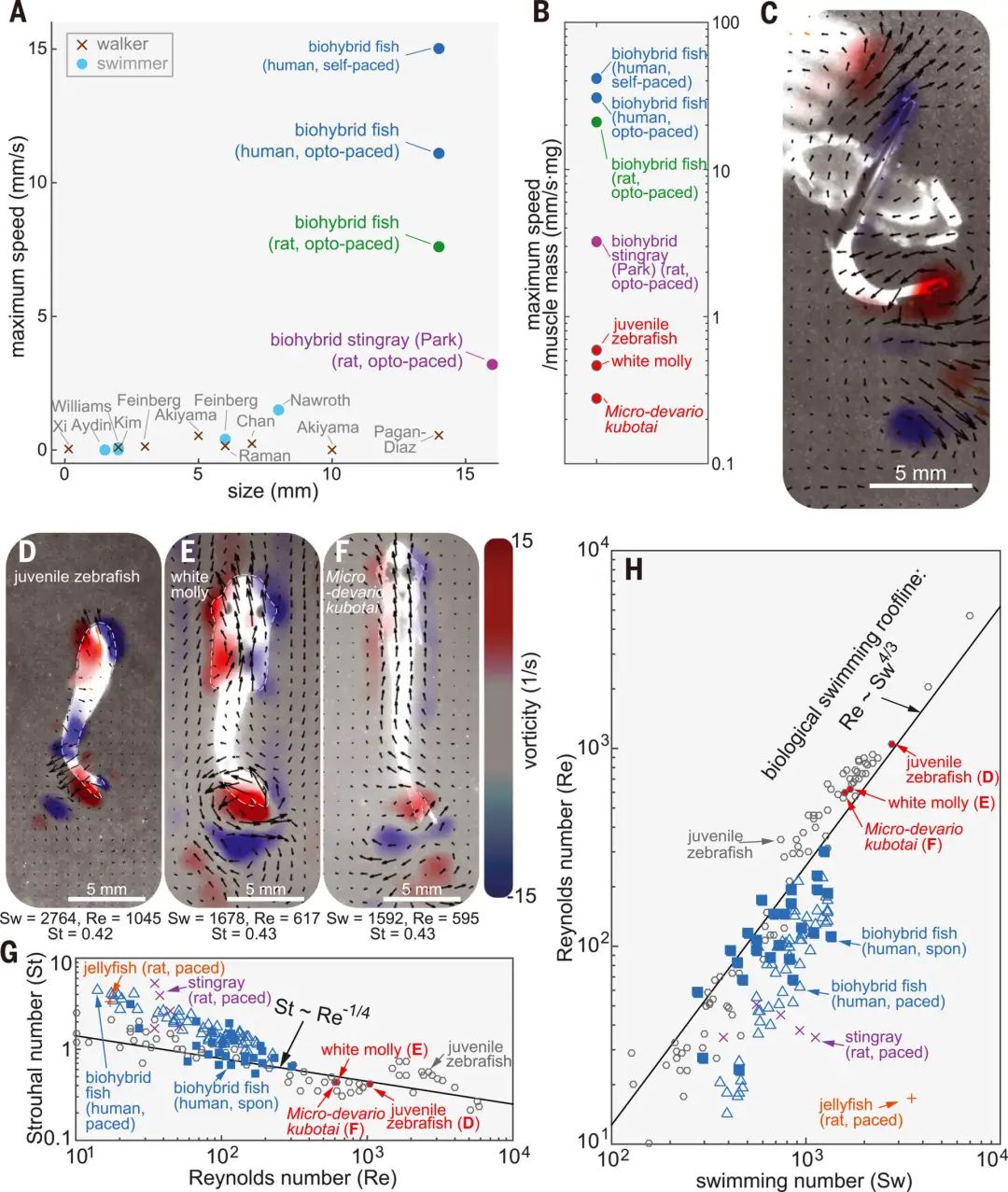
接下來,研究者在測試中,確定了由人類干細胞來源的心肌細胞重建的肌肉拮抗收縮,能通過機械電子信號維持自發的節律性收縮。 研究團隊還開發了能模仿竇房結功能、對心肌細胞進行規律性起搏的節點性人造器官,研究者稱之為G節點。倫敦國王學院的Mathias Gautel稱:「這讓學界對心率規律在真實收縮性生物結構上如何發生有了全新認知。」 為了復制竇房結的電絕緣結構,研究人員通過一個灌電流離子通道在模擬竇房結的G節點和肌肉組織之間建立了一個電連接。 因此,生物雜交魚的肌肉雙分子層和G節點共同使其產生一種連續的節律來調節肌肉的拮抗作用,從而產生自發的、協調的身體尾鰭運動。 按Kit Parker的說法:「誰都能用膠泥塑造出心臟模型。任何人也都能在培養皿里倒上一堆腫瘤細胞,直到細胞群復制生長成自我搏動的瘤塊,然后稱之為類心臟有機體。這些行為都不能真正復現一個在人的一生中能自我搏動數十億次而且自行同步修復細胞的器官基礎生態物理。這才是真正的難點,這也是我們的研究重心。」 實驗用合成魚游了108天、進行相當于3800次心臟律動的自動動作,而且游速比同等大小的真實魚類更快。
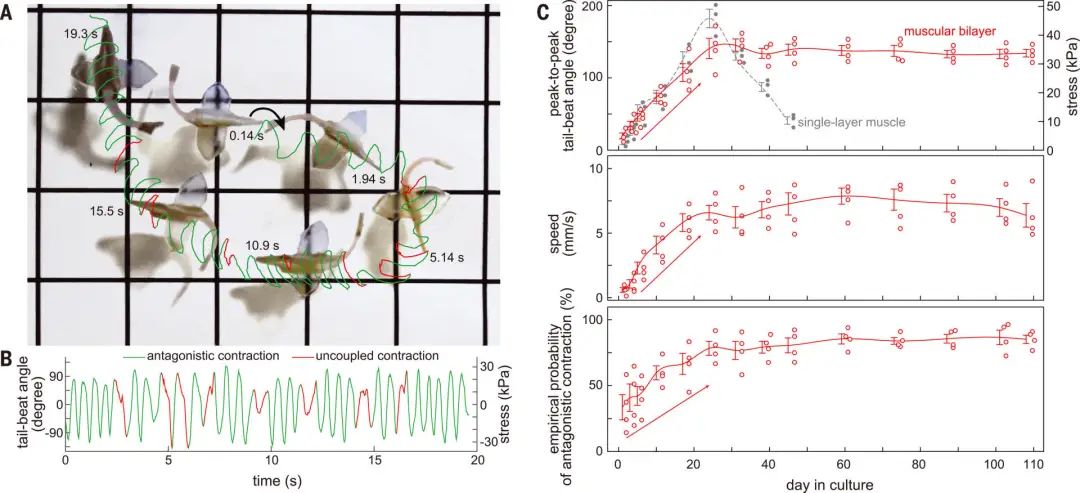
游動天數與細胞活躍記錄 倫敦國王學院的Mathias Gautel稱:「如果一切順利的話,現在一般從動物活體心臟剝離的主細胞能在體外存活二到四周。哈佛團隊能將這一時間延長到幾乎與小動物生命周期一樣長,這一結果令人驚嘆。」
「實驗體放孵化器里,然后……忘了管」
不過這次實驗的成功,還有其他有趣的因素。 「基本上我們一直把這些魚放在孵化器里面,之后兩三個禮拜我們根本就把這回事忘了。」Sung-Jin Park說道。他之前是哈佛大學疾病生物物理學組的博士后研究員。同時,他還是這篇研究人造魚的論文的共同一作。「我們把孵化器打開,發現這些魚都在游來游去。」

但是Kit Parker的最切近目標是,不被抓起來。 「我沒在開玩笑。上次我們搞人造生物復合體的時候,波士頓的司法部官員就開始調查我們有無濫用國立衛生研究院(NIH)的項目撥款。」三位NIH負責該項目的官員后來發表了一篇論文,探討該研究在科學上的成就,才讓這次調查得以結束。 「如果你工作的方法太過于創新,那不一定所有人都能接受。但是反常規的研究路徑,和瘋狂胡搞還是有區別的。我覺得現在大家開始能體會這種區別了。」 「所以當務之急還是不要被捉進號子里。之后我們才能接著搞科研。我們長期的目標是拯救那些得了心臟病的孩子們。」Kit Parker說。
未來目標與應用場景
Parker說:「我們的最終目標,是制造出真正能為兒童病患替代有缺陷心臟的人造活體心臟。 當其他人試圖為再生性醫藥研究制造體外人類心臟時,他們總想著完美復制心臟的解剖學結構,或者讓催化的體外心肌組織復制簡單跳動。 但我們團隊的設計主旨,是復現心臟工作的生物物理學規律,這要難得多。不比簡單將心臟結構作為藍圖的搭樂高式運作,我們要確定心臟搏動的生物物理學基礎、將之作為設計主指標,然后做成易于觀察的活性魚。」 了解這些控制心肌泵血的規律,就能更好地治療心臟病。 心肌細胞合成魚的確也讓研究者更好理解了心臟功能。過往科學家一直認為當人體心臟在搏動間隔的舒張期,血液是被動地充滿心室。而合成魚的縮張記錄表明該過程很可能更主動。 Parker稱團隊現在正在尋求將這一成果應用在人工心臟的開發上,「力求將這次研究的所得應用在小兒心臟疾病與再生性醫藥等領域的拓展中,而且我們要開發下一個生物復合裝置。」 Park說,未來他想把這些人造動物送到太空中去。他認為這是研究微重力引發的肌肉萎縮的好辦法。還能研究在太空失重的環境下,肌肉組織是如何衰弱的。 宇航員都很熟悉在宇宙中待太長時間之后的肌肉流失現象。Park說,也許他們還可以把這里得到的結論應用于此,去研究衰老是如何導致肌肉萎縮的。

其他一些人則在各自的研究領域上開始應用上述的研究成果。 William Poole是波士頓兒童醫院的一名心臟病學家,他與Parker的團隊一同研究如何對「生體組織芯片」進行臨床測試。這些微組織芯片像是微觀的心臟病灶組織活體,能在不對組織源供體造成傷害的情況下推進實驗和研究。 2021年開始,Parker和Poole就開始利用這項試驗的數據在實驗室里模擬兒童心臟病,試驗藥物干預、心臟起搏器置入,還有其它用以維持生命的干預手段。 人造心臟移植入人體這一大眾寄望已久的目標,正在堅定地被實現中。